Техника - молодёжи 1978-11, страница 11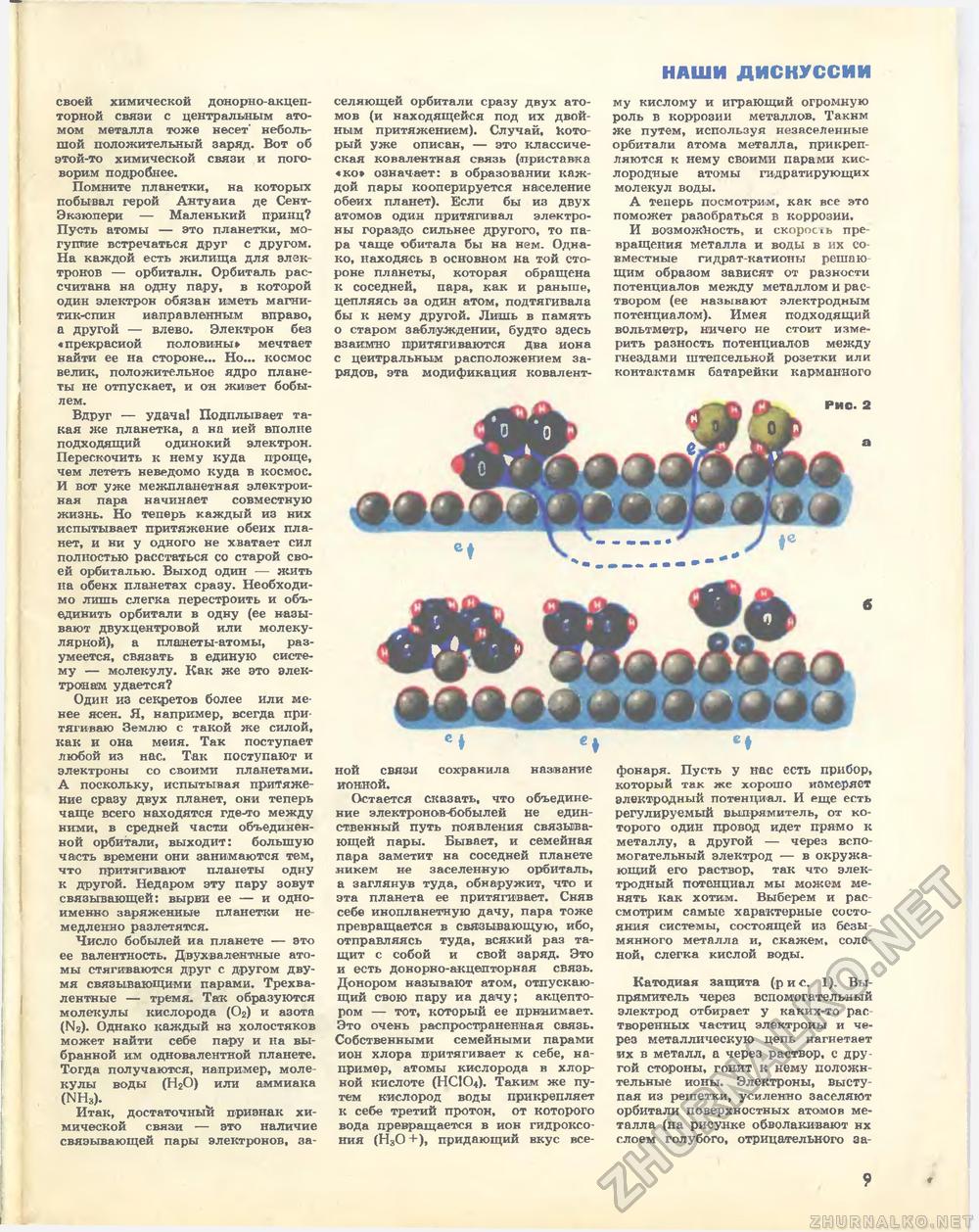
НАШИ ДИСКУССИИ своей химическом донорно-акцеп-торной связи с центральным атомом металла тоже несет' небольшой положительный заряд. Вот об этой-то химической связи и поговорим подробнее. Помните планетки, на которых побывал герой Антуаиа де Сент-Экзюпери — Маленький принц? Пусть атомы — это планетки, могущие встречаться друг с другом. На каждой есть жилища для электронов — орбиталн. Орбиталь рассчитана на одну пару, в которой один электрон обязан иметь магнитик-спин направленным вправо, а другой — влево. Электрон без «прекрасной половины» мечтает найти ее на стороне... Но... космос велик, положительное ядро планеты не отпускает, и он живет бобылем. Вдруг — удача! Подплывает такая же планетка, а на ней вполне подходящий одинокий электрон. Перескочить к нему куда проще, чем лететь неведомо куда в космос. И вот уже межпланетная электронная пара начинает совместную жизнь. Но теперь каждый из них испытывает притяжение обеих планет, и ни у одного не хватает сил полностью расстаться со старой своей орбиталыо. Выход один — жить на обенх планетах сразу. Необходимо лишь слегка перестроить и объединить орбитали в одну (ее называют двухцентровой или молекулярной), а планеты-атомы, разумеется, связать в единую систему — молекулу. Как же это электронам удается? Один из секретов более или менее ясен. Я, например, всегда при тягиваю Землю с такой же силой, как и она меня. Так поступает любой из нас. Так поступают и электроны со своими планетами. А поскольку, испытывая притяжение сразу двух планет, они теперь чаще всего находятся где-то между ними, в средней части объединенной орбитали, выходит: большую часть времени они занимаются тем, что притягивают планеты одну к другой. Недаром эту пару зовут связывающей: вырви ее — и одноименно заряженные планетки немедленно разлетятся. Число бобылей иа планете — это ее валентность. Двухвалентные атомы стягиваются друг с другом двумя связывающими парами. Трехвалентные — тремя. Так образуются молекулы кислорода (02) и азота (N2). Однако каждый нз холостяков может найти себе пару и на выбранной им одновалентной планете. Тогда получаются, например, молекулы воды (НгО) или аммиака (NH3). Итак, достаточный признак химической связи — это наличие связывающей пары электронов, за селяющей орбитали сразу двух атомов (и находящейся под их двойным притяжением). Случай, Который уже описан, — это классическая ковалентная связь (.приставка «ко» означает: в образовании каждой пары кооперируется население обеих планет). Если бы из двух атомов один притягивал электроны гораздо сильнее другого, то пара чаще обитала бы на нем. Однако, находясь в основном на той стороне планеты, которая обращена к соседней, пара, как и раньше, цепляясь за один атом, подтягивала бы к нему другой. Лишь в память о старом заблуждении, будто здесь взаимно притягиваются два иона с центральным расположением зарядов, эта модификация ковалент- му кислому и играющий огромную роль в коррозии металлов. Таким же путем, используя незаселенные орбитали атома металла, прикрепляются к нему своими парами кислородные атомы гидратирующих молекул воды. А теперь посмотрим, как все это поможет разобраться в коррозии. И возможность, и cKopocib превращения металла и воды в их совместные гидрат-катионы решаю щим образом зависят от разности потенциалов между металлом и раствором (ее называют электродным потенциалом). Имея подходящий вольтметр, ничего не стоит измерить разность потенциалов между гнездами штепсельной розетки или контактами батарейки карманного ной связи сохранила название ионной. Остается сказать, что объединение электронов-бобылей не единственный путь появления связывающей пары. Бывает, и семейная пара заметит на соседней планете никем не заселенную орбиталь, а заглянув туда, обнаружит, что и эта планета ее притягивает. Сняв себе инопланетную дачу, пара тоже превращается в связывающую, ибо, отправляясь туда, всякий раз тащит с собой и свой заряд. Это и есть донорно-акцепторная связь. Донором называют атом, отпускающий свою пару иа дачу; акцептором — тот, который ее принимает. Это очень распространенная связь. Собственными семейными парами ион хлора притягивает к себе, например, атомы кислорода в хлорной кислоте (НСЮч). Таким же путем кислород воды прикрепляет к себе третий протон, от которого вода превращается в ион гидроксо-ния (Н30 +), придающий вкус все фонаря. Пусть у нас есть прибор, который так же хорошо измеряет электродный потенциал. И еще есть регулируемый выпрямитель, от которого один провод идет прямо к металлу, а другой — через вспомогательный электрод — в окружающий его раствор, так что электродный потенциал мы можем менять как хотим. Выберем и рас смотрим самые характерные состояния системы, состоящей из безы мянного металла и, скажем, соленой, слегка кислой воды. Катодная защита (р и с. 1). Выпрямитель через вспомогательный электрод отбирает у каких-то рас творенных частиц электроны и через металлическую цепь нагнетает их в металл, а через раствор, с дру гой стороны, гонит к нему положительные ионы. Электроны, выступая из решетки, усиленно заселяют орбитали поверхностных атомов металла (на рисунке обволакивают нх слоем голубого, отрицательного за- 9 * |








