Техника - молодёжи 1978-12, страница 44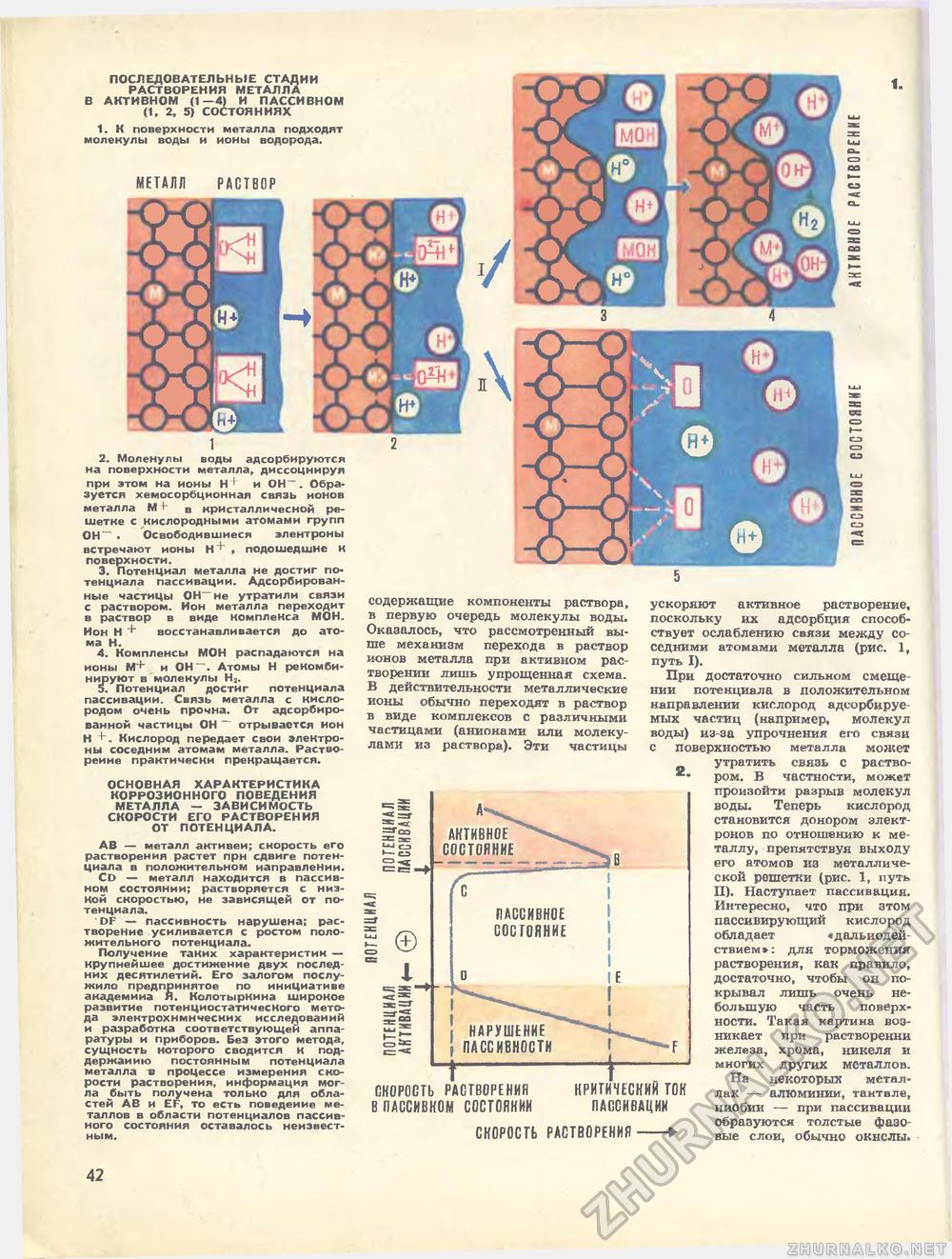
ПОСЛЕДОВАТЕЛЬНЫЕ СТАДИИ РАСТВОРЕНИЯ МЕТАЛЛА В АКТИВНОМ (1—4) И ПАССИВНОМ (1, 2, 5) СОСТОЯНИЯХ 1. К поверхности металла подходят молекулы воды и ионы водорода. 2. Моленулы воды адсорбируются на поверхности металла, диссоциируя при этом на иоиы Н+ и ОН-. Образуется хемосорбционная связь ионов металла М+ в кристалличесной решетке с кислородными атомами групп 0Н~ . Освободившиеся элентроны встречают ионы Н ' , подошедшие К поверхности. 3. Потенциал металла не достиг потенциала пассивации. Адсорбированные частицы ОН-не утратили связи с раствором. Ион металла переходит в раствор в виде комплекса МОН. Ион Н + восстанавливается до атома Н. 4. Компленсы МОН распадаются на ионы М+ и ОН-. Атомы Н рекомби-нируют в молекулы Н2. 5. Потенциал достиг потенциала пассивации. Связь металла с кислородом очень прочна. От адсорбированной частицы ОН ~ отрывается ион Н +. Кислород передает свои электроны соседним атомам металла. Растворение практически прекращается. ОСНОВНАЯ ХАРАКТЕРИСТИКА КОРРОЗИОННОГО ПОВЕДЕНИЯ МЕТАЛЛА — ЗАВИСИМОСТЬ СКОРОСТИ ЕГО РАСТВОРЕНИЯ ОТ ПОТЕНЦИАЛА. АВ — металл активен; снорость его растворения растет прн сдвиге потенциала в положительном направлении. CD — металл находится в пассивном состоянии; растворяется с низкой скоростью, не зависящей от потенциала. DF — пассивность нарушена; растворение усиливается с ростом положительного потенциала. Получение таних характеристик — крупнейшее достижение двух последних десятилетий. Его залогом послужило предпринятое по инициативе академииа Я. Колотыркина широкое развитие потенциостатического метода электрохнмнчесних исследований и разработка соответствующей аппаратуры и приборов. Без этого метода, сущность которого сводится к поддержанию постоянным потенциала металла в процессе измерения скорости растворения, информация могла быть получена только для областей АВ и EF, то есть поведение металлов в области потенциалов пассивного состояния оставалось неизвестным. содержащие компоненты раствора, в первую очередь молекулы воды. Оказалось, что рассмотренный выше механизм перехода в раствор ионов металла при активном растворении лишь упрощенная схема. В действительности металлические ионы обычно переходят в раствор в виде комплексов с различными частицами (анионами или молекулами из раствора). Эти частицы tJJ сэ >— сэ © ПАССИВНОЕ СОСТОЯНИЕ I ! НАРУШЕНИЕ ( ПАССИВНОСТИ СКОРОСТЬ РАСТВОРЕНИЯ В ПАССИВНОМ СОСТОЯНИИ КРИТИЧЕСКИЙ ток ПАССИВАЦИИ СКОРОСТЬ РАСТВОРЕНИЯ ускоряют активное растворение, поскольку их адсорбция способствует ослаблению связи между соседними атомами металла (рис. 1, путь I). При достаточно сильном смещении потенциала в положительном направлении кислород адсорбируемых частиц (например, молекул воды) из-за упрочнения его связи с поверхностью металла может утратить связь с раство-ром. В частности, может произойти разрыв молекул воды. Теперь кислород становится донором электронов по отношению к металлу, препятствуя выходу его атомов из металлической решетки (рис. 1, путь II). Наступает пассивация. Интересно, что при этом пассивирующий кислород обладает «дальнодей ствием»: для торможения растворения, как правило, достаточно, чтобы он покрывал лишь очень небольшую часть поверхности. Такая картина возникает при растворении железа, хрома, никеля и многих других металлов. На некоторых металлах — алюминии, тантале, ниобии — при пассивации образуются толстые фазовые слои, обычно окислы. 42 |








