Техника - молодёжи 1979-01, страница 43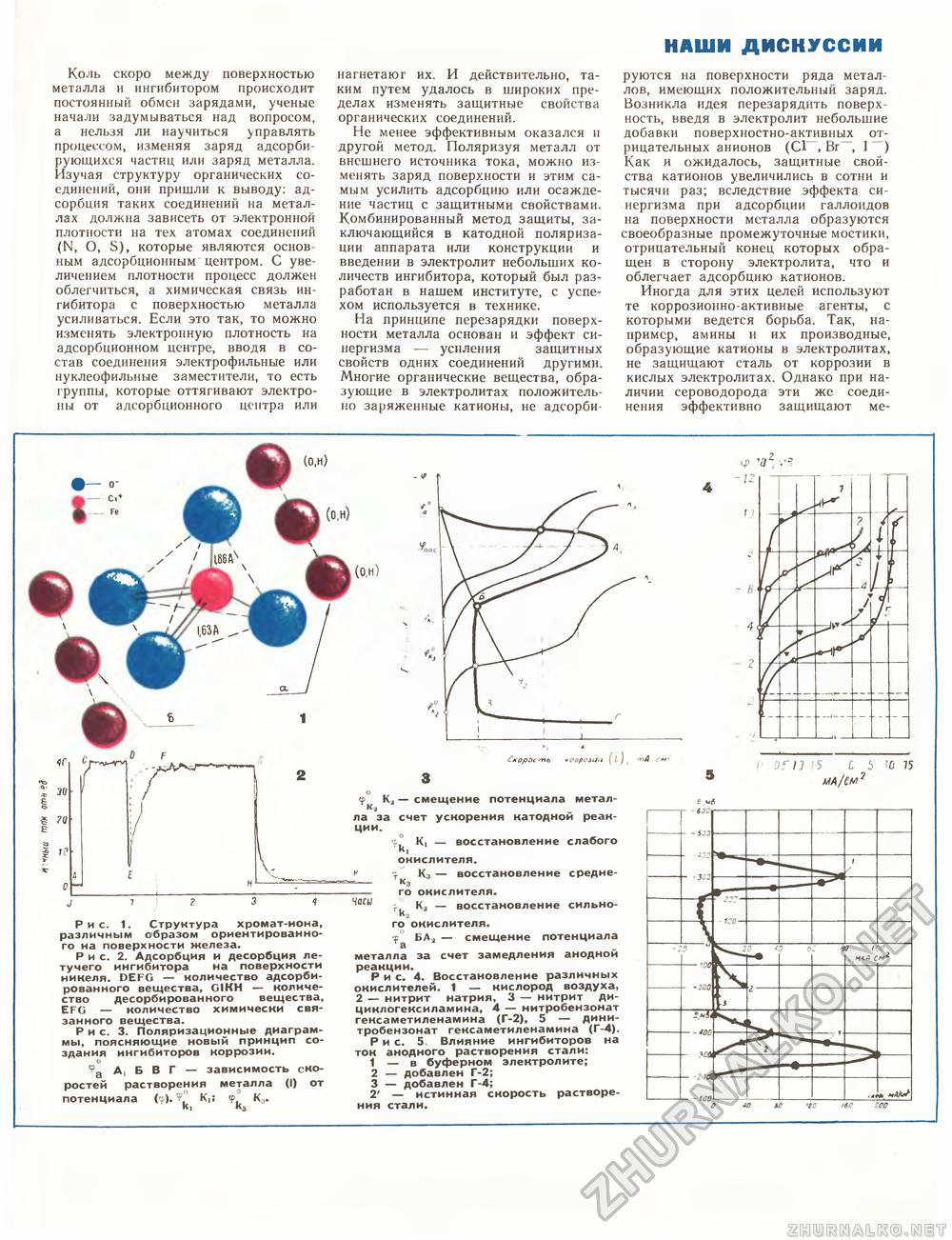
наши дискуссии Коль скоро между поверхностью металла и ингибитором происходит постоянный обмен зарядами, ученые начали задумываться над вопросом, а нельзя ли научиться управлять процессом, изменяя заряд адсорбирующихся частиц или заряд металла. Изучая структуру органических соединений, они пришли к выводу: адсорбция таких соединений на металлах должна зависеть от электронной плотности на тех атомах соединений (N, О, S), которые являются основным адсорбционным центром. С увеличением плотности процесс должен облегчиться, а химическая связь ингибитора с поверхностью металла усиливаться. Если это так, то можно изменять электронную плотность на адсорбционном центре, вводя в состав соединения электрофильные или нуклеофильные заместители, то есть группы, которые оттягивают электроны от адсорбционного центра или нагнетают их. И действительно, таким путем удалось в широких пределах изменять защитные свойства органических соединений. Не менее эффективным оказался и другой метод. Поляризуя металл от внешнего источника тока, можно изменять заряд поверхности и этим самым усилить адсорбцию или осаждение частиц с защитными свойствами. Комбинированный метод защиты, заключающийся в катодной поляризации аппарата или конструкции и введении в электролит небольших количеств ингибитора, который был разработан в нашем институте, с успехом используется в технике. На принципе перезарядки поверхности металла основан и эффект синергизма — усиления защитных свойств одних соединений другими. Многие органические вещества, образующие в электролитах положительно заряженные катионы, не адсорби руются на поверхности ряда металлов, имеющих положительный заряд. Возникла идея перезарядить поверхность, введя в электролит небольшие добавки поверхностно-активных отрицательных анионов (Cl", Br~~, 1 Как и ожидалось, защитные свойства катионов увеличились в сотни и тысячи раз; вследствие эффекта синергизма при адсорбции галлоидов на поверхности металла образуются своеобразные промежуточные мостики, отрицательный конец которых обращен в сторону электролита, что и облегчает адсорбцию катионов. Иногда для этих целей используют те коррозионно-активные агенты, с которыми ведется борьба. Так, например, амины и их производные, образующие катионы в электролитах, не защищают сталь от коррозии в кислых электролитах. Однако при наличии сероводорода эти же соединения эффективно защищают ме- я> 40z V.3 Рис. 1. Структура хромат-иона, различным образом ориентированного на поверхности железа. Рис. 2. Адсорбция и десорбция летучего ингибитора на поверхности никеля. DEFG — количество адсорбированного вещества, GIKH — количество десорбированного вещества, EFG — количество химически связанного вещества. Рис. 3. Поляризационные диаграммы, поясняющие новый принцип создания ингибиторов коррозии. о А, Б В Г - зависимость скоростей растворения металла (i) от потенциала (?). ® К,; <р Ка. "1 «3 4 Скорое пь «ооролии (L) ( ъА см- смещение потенциала металла за счет ускорения катодной реакции. Ki — восстановление слабого Ki окислителя. К3 — восстановление среднего окислителя. К2 — восстановление сильного окислителя. <р° БА2 — смещение потенциала металла за счет замедления анодной реакции. Рис. 4. Восстановление различных окислителей. 1 — кислород воздуха, 2 — нитрит натрия, 3 — нитрит ди-циклогексиламина, 4 — нитробензонат гексаметиленамина (Г-2), 5 — дини-тробензонат гексаметиленамина (Г-4). Рис. 5, Влияние ингибиторов на ток анодного растворения стали: 1 — в буферном электролите; 2 — добавлен Г-2; 3 — добавлен Г-4; 2' — истинная скорость растворения стали. £и&
or и '5 С 5 ^ 75 МА/СМ7 |
|||||||||||||||||||||||||||||||||||||||||||||








