Юный техник 1963-08, страница 30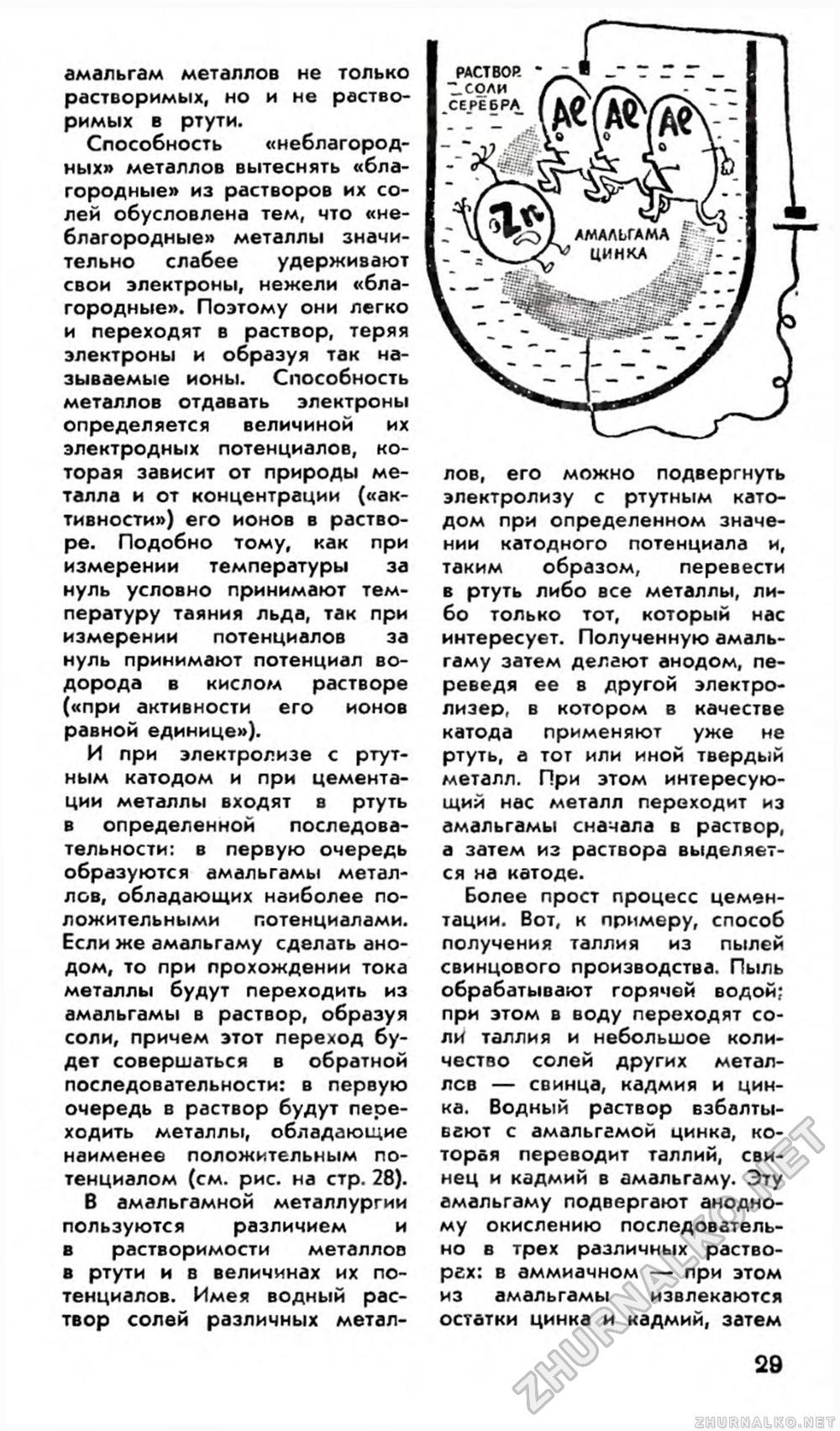
амальгам металлов не только растворимых, но и не растворимых в ртути. Способность «неблагородных» металлов вытеснять «благородные» из растворов их солей обусловлена тем, что «неблагородные» металлы значительно слабее удерживают свои электроны, нежели «благородные». Поэтому они легко и переходят в раствор, теряя электроны и образуя так называемые ионы. Способность металлов отдавать электроны определяется величиной их электродных потенциалов, которая зависит от природы металла и от концентрации («активности») его ионов в растворе. Подобно тому, как при измерении температуры за нуль условно принимают температуру таяния льда, так при измерении потенциалов за нуль принимают потенциал водорода в кислом растворе («при активности его ионов равной единице»). И при электролизе с ртутным катодом и при цементации металлы входят в ртуть в определенной последовательности: в первую очередь образуются амальгамы металлов, обладающих наиболее положительными потенциалами. Если же амальгаму сделать анодом, то при прохождении тока металлы будут переходить из амальгамы в раствор, образуя соли, причем этот переход будет совершаться в обратной последовательности: в первую очередь в раствор будут переходить металлы, обладающие наименее положительным потенциалом (см. рис. на стр. 28). В амальгамной металлургии пользуются различием и в растворимости металлов в ртути и в величинах их потенциалов. Имея водный раствор солей различных метал лов, его можно подвергнуть электролизу с ртутным катодом при определенном значении катодного потенциала и, таким образом, перевести в ртуть либо все металлы, либо только тот, который нас интересует. Полученную амальгаму затем делают анодом, переведя ее в другой электролизер, в котором в качестве катода применяют уже не ртуть, а тот или иной твердый металл. При этом интересующий нас металл переходит из амальгамы сначала в раствор, а затем из раствора выделяется на катоде. Более прост процесс цементации. Вот, к примеру, способ получения таллия из пылей свинцового производства. Пыль обрабатывают горячой водой; при этом в воду переходят соли таллия и небольшое количество солей других металлов — свинца, кадмия и цинка. Водный раствор взбалтывают с амальгамой цинка, которая переводит таллий, свинец и кадмий в амальгаму. Эту амальгаму подвергают анодному окислению последовательно в трех различных раство-рех: в аммиачном — при этом из амальгамы извлекаются остатки цинка и кадмий, затем 29 |








