Техника - молодёжи 1952-12, страница 6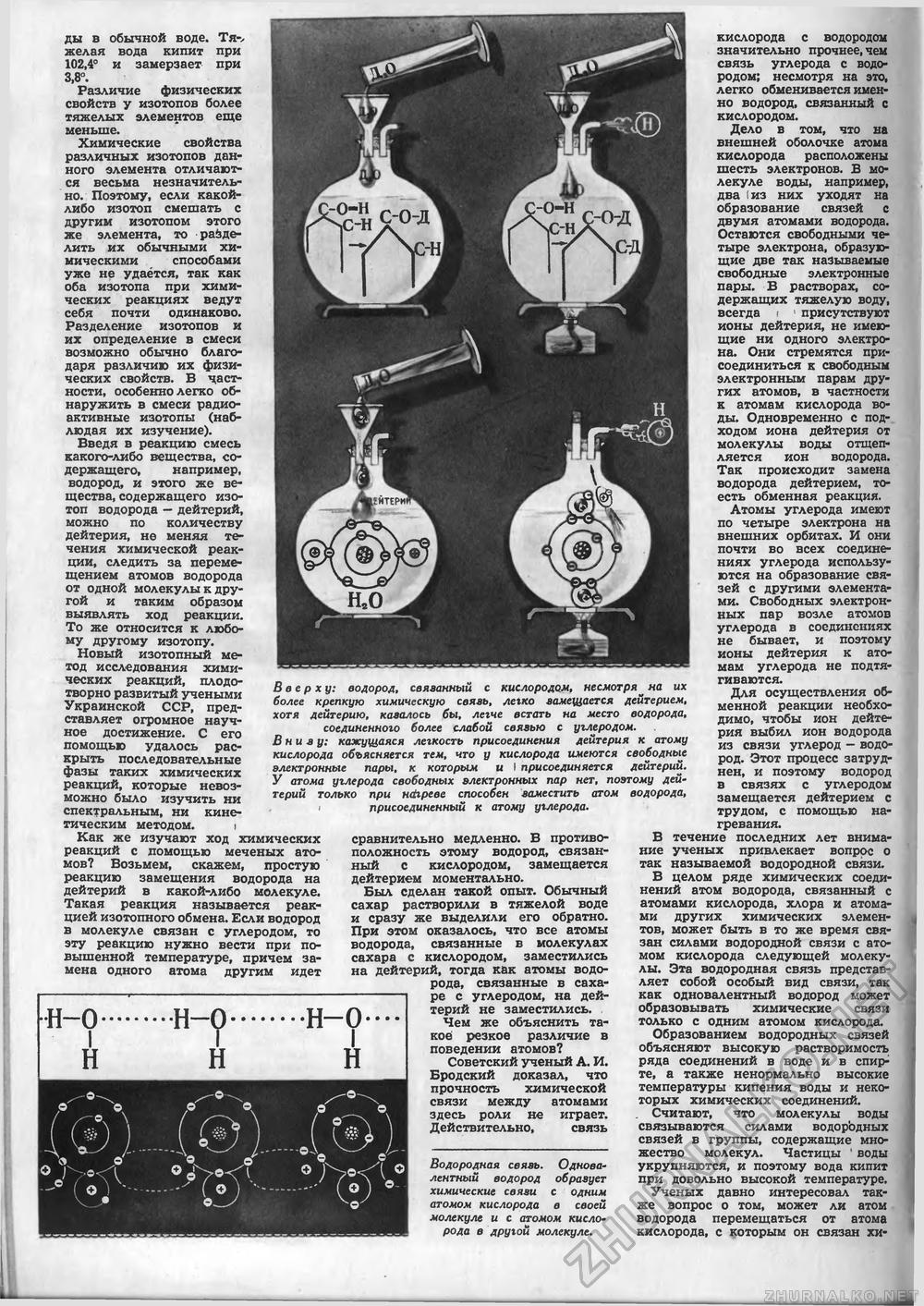
6 ды в обычной воде. Тя-> желая вода кипит при 102,4° и замерзает при 3,8°. Различие физических свойств у изотопов более тяжелых элементов еще меньше. Химические свойства различных изотопов данного элемента отличаются весьма незначительно. Поэтому, если какой-либо изотоп смешать с другим изотопом этого же элемента, то разделить их обычными химическими способами уже не удаётся, так как оба изотопа при химических реакциях ведут себя почти одинаково. Разделение изотопов и их определение в смеси возможно обычно благодаря различию их физических свойств. В частности, особенно легко обнаружить в смеси радиоактивные изотопы (наблюдая их изучение). Введя в реакцию смесь какого-либо вещества, содержащего, например, водород, и этого же вещества, содержащего изотоп водорода — дейтерий, можно по количеству дейтерия, не меняя течения химической реакции, следить за перемещением атомов водорода от одной молекулы к другой и таким образом выявлять ход реакции. То же относится к любому другому изотопу. Новый изотопный метод исследования химических реакций, плодотворно развитый учеными Украинской ССР, представляет огромное научное достижение. С его помощью удалось раскрыть последовательные фазы таких химических реакций, которые невозможно было изучить ни спектральным, ни кинетическим методом. | Как же изучают ход химических реакций с помощью меченых атомов? Возьмем, скажем, простую реакцию замещения водорода на дейтерий в какой-либо молекуле. Такая реакция называется реакцией изотопного обмена. Если водород в молекуле связан с углеродом, то эту реакцию нужно вести при повышенной температуре, причем замена одного атома другим идет Н-0 Вверху: водород, связанный с кислородом, несмотря на их более крепкую химическую связь, легко замещается дейтерием, хотя дейтерию, казалось бы, легче встать на место водорода, соединенного более слабой связью с углеродом. Внизу: кажущаяся легкость присоединения дейтерия к атому кислорода объясняется тем, что у кислорода имеются свободные электронные пары, к которым и I присоединяется дейтерий. У атома углерода свободных электронных пар нет, поэтому дейтерий только при Hdxpeee способен заместить атом водорода, I присоединенный к атому углерода. сравнительно медленно. В противоположность этому водород, связанный с кислородом, замещается дейтерием моментально. Был сделан такой опыт. Обычный сахар растворили в тяжелой воде и сразу же выделили его обратно. При этом оказалось, что все атомы водорода, связанные в молекулах сахара с кислородом, заместились на дейтерий, тогда как атомы водорода, связанные в сахаре с углеродом, на дейтерий не заместились. Чем же объяснить та-коё резкое различие в поведении атомов? Советский ученый А. И. Бродский доказал, что прочность химической связи между атомами здесь роли не играет. Действительно, связь Водородная связь. Одновалентный водород образует химические связи с одним атомом кислорода в своей молекуле и с атомом кисло-рода в другой молекуле. кислорода с водородом значительно прочнее, чем связь углерода с водородом; несмотря на это, легко обменивается именно водород, связанный с кислородом. Дело в том, что на внешней оболочке атома кислорода расположены шесть электронов. В молекуле воды, например, два (из них уходят на образование связей с двумя атомами водорода. Остаются свободными четыре электрона, образующие две так называемые свободные электронные пары. В растворах, содержащих тяжелую воду, всегда i 1 присутствуют ионы дейтерия, не имеющие ни одного электрона. Они стремятся присоединиться к свободным электронным парам других атомов, в частности к атомам кислорода воды. Одновременно с подходом иона дейтерия от молекулы воды отщепляется ион водорода. Так происходит замена водорода дейтерием, то-есть обменная реакция. Атомы углерода имеют по четыре электрона на внешних орбитах. И они почти во всех соединениях углерода используются на образование связей с другими элементами. Свободных электронных пар возле атомов углерода в соединениях не бывает, и поэтому ионы дейтерия к атомам углерода не подтягиваются. Для осуществления обменной реакции необходимо, чтобы ион дейтерия выбил ион водорода из связи углерод — водород. Этот процесс затруднен, и поэтому водород в связях с углеродом замещается дейтерием с трудом, с помощью нагревания. В течение последних лет внимание ученых привлекает вопрос о так называемой водородной связи. В целом ряде химических соединений атом водорода, связанный с атомами кислорода, хлора и атомами других химических элементов, может быть в то же время связан силами водородной связи с атомом кислорода следующей молекулы. Эта водородная связь представляет собой особый вид связи, так как одновалентный водород может образовывать химические связи только с одним атомом кислорода. Образованием водородных связей объясняют высокую растворимость ряда соединений в воде и в спирте, а также ненормально высокие температуры кипения воды и некоторых химических соединений. Считают, что молекулы воды связываются силами водорЬдных связей в группы, содержащие множество молекул. Частицы 1 воды укрупняются, и поэтому вода кипит при довольно высокой температуре. Ученых давно интересовал также вопрос о том, может ли атом водорода перемещаться от атома кислорода, с которым он связан хи |








