Техника - молодёжи 1980-02, страница 21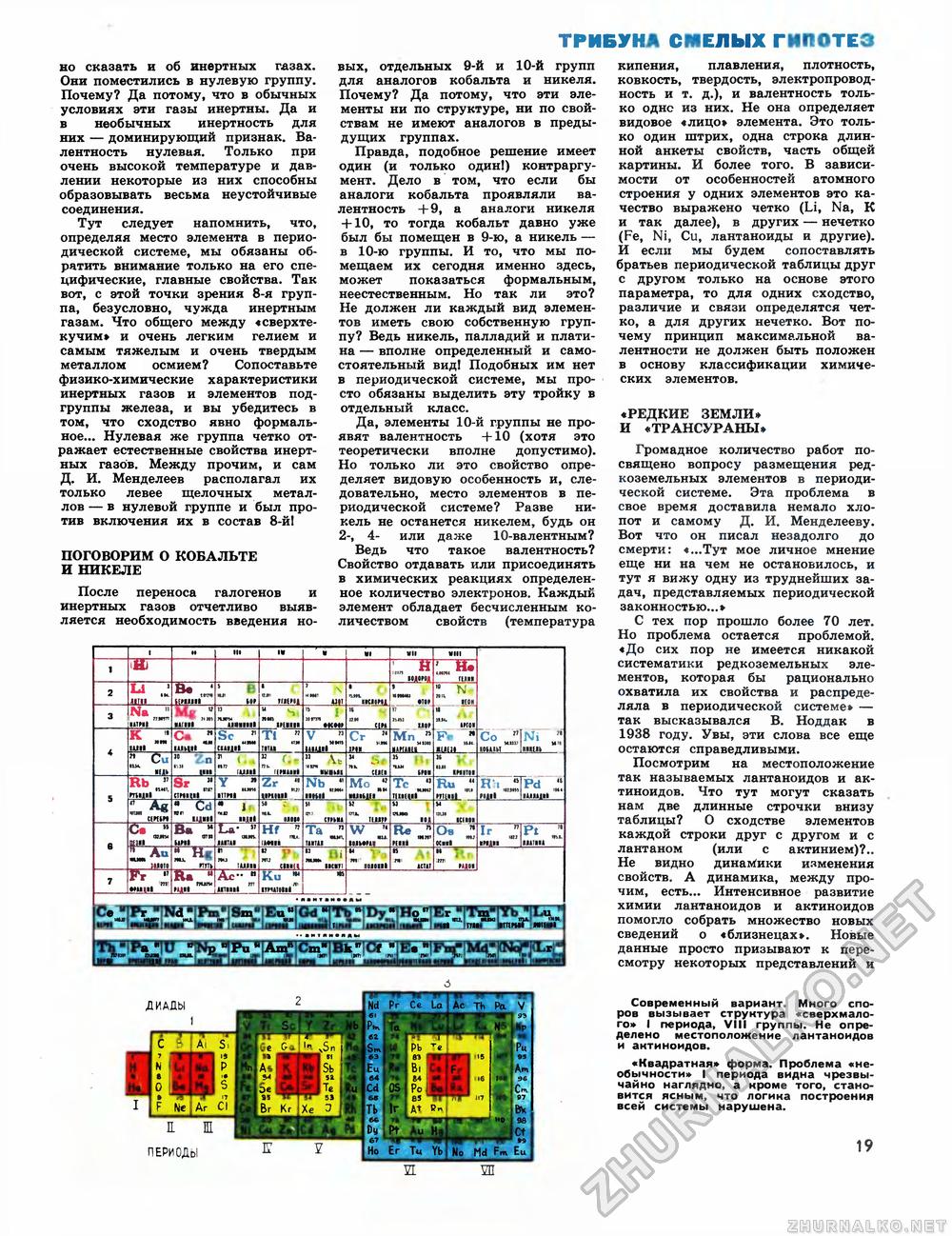
ТРИБУНА СМЕЛЫХ ГИПОТЕЗ но сказать и об инертных газах. Они поместились в нулевую группу. Почему? Да потому, что в обычных условиях эти газы инертны. Да и в необычных инертность для них — доминирующий признак. Валентность нулевая. Только при очень высокой температуре и давлении некоторые из них способны образовывать весьма неустойчивые соединения. Тут следует напомнить, что, определяя место элемента в периодической системе, мы обязаны обратить внимание только на его специфические, главные свойства. Так вот, с этой точки зрения 8-я группа, безусловно, чужда инертным газам. Что общего между «сверхтекучим» и очень легким гелием и самым тяжелым и очень твердым металлом осмием? Сопоставьте физико-химические характеристики инертных газов и элементов подгруппы железа, и вы убедитесь в том, что сходство явно формальное... Нулевая же группа четко отражает естественные свойства инертных газов. Между прочим, и сам Д. И. Менделеев располагал их только левее щелочных металлов — в нулевой группе и был против включения их в состав 8-й! ПОГОВОРИМ О КОБАЛЬТЕ И НИКЕЛЕ После переноса галогенов и инертных газов отчетливо выявляется необходимость введения но вых, отдельных 9-й и 10-й групп для аналогов кобальта и никеля. Почему? Да потому, что эти элементы ни по структуре, ни по свойствам не имеют аналогов в предыдущих группах. Правда, подобное решение имеет один (и только один!) контраргумент. Дело в том, что если бы аналоги кобальта проявляли валентность + 9, а аналоги никеля + 10, то тогда кобальт давно уже был бы помещен в 9-ю, а никель — в 10-ю группы. И то, что мы помещаем их сегодня именно здесь, может показаться формальным, неестественным. Но так ли это? Не должен ли каждый вид элементов иметь свою собственную группу? Ведь никель, палладий и платина — вполне определенный и самостоятельный вид! Подобных им нет в периодической системе, мы просто обязаны выделить эту тройку в отдельный класс. Да, элементы 10-й группы не проявят валентность +10 (хотя это теоретически вполне допустимо). Но только ли это свойство определяет видовую особенность и, следовательно, место элементов в периодической системе? Разве никель не останется никелем, будь он 2-, 4- или даже 10-валентным? Ведь что такое валентность? Свойство отдавать или присоединять в химических реакциях определенное количество электронов. Каждый элемент обладает бесчисленным количеством свойств (температура кипения, плавления, плотность, ковкость, твердость, электропроводность и т. д.), и валентность только однс из них. Не она определяет видовое «лицо» элемента. Это только один штрих, одна строка длинной анкеты свойств, часть общей картины. И более того. В зависимости от особенностей атомного строения у одних элементов это качество выражено четко (Li, Na, К и так далее), в других — нечетко (Fe, Ni, Си, лантаноиды и другие). И если мы будем сопоставлять братьев периодической таблицы друг с другом только на основе этого параметра, то для одних сходство, различие и связи определятся четко, а для других нечетко. Вот почему принцип максимальной валентности не должен быть положен в основу классификации химических элементов. ♦РЕДКИЕ ЗЕМЛИ» И «ТРАНСУ РАНЫ» Громадное количество работ посвящено вопросу размещения редкоземельных элементов в периодической системе. Эта проблема в свое время доставила немало хлопот и самому Д. И. Менделееву. Вот что он писал незадолго до смерти: «...Тут мое личное мнение еще ни на чем не остановилось, и тут я вижу одну из труднейших задач, представляемых периодической законностью...» С тех пор прошло более 70 лет. Но проблема остается проблемой. «До сих пор не имеется никакой систематики редкоземельных элементов, которая бы рационально охватила их свойства и распределяла в периодической системе» — так высказывался В. Ноддак в 1938 году. Увы, эти слова все еще остаются справедливыми. Посмотрим на местоположение так называемых лантаноидов и актиноидов. Что тут могут сказать нам две длинные строчки внизу таблицы? О сходстве элементов каждой строки друг с другом и с лантаном (или с актинием)?.. Не видно динамики изменения свойств. А динамика, между прочим, есть... Интенсивное развитие химии лантаноидов и актиноидов помогло собрать множество новых сведений о «близнецах». Новые данные просто призывают к пересмотру некоторых представлений и Современный вариант. Много споров вызывает структура «сверхмалого» I периода, VIII группы. Не определено местоположение лантаноидов и актиноидов. «Квадратная» форма. Проблема «необычности» I периода видна чрезвычайно наглядно, а кроме того, становится ясным, что логика построения всей системы нарушена. 19 "ТНГ и~ Na Ш|» Rb Си Jilt |ег f- А« CWIW 1ШИ с. ЩЦИ П Sr £ лаш» уса вГ HHI , "Hi Sc U И'чч" Y 1ТТЩ та» I щи УГШЦ TI ИТ» пит» Zr Hf £ !ШЦ|_ Nb, "ни ' Та Cr Г~гг ___т» Мп." итт» Мо „ МШШ1 W Ш И1М«|_ ОТ» Тс _ Т!»щГ* Re ним гни» N ИИ Ни mm Ов ОСм» Со J] Ji НОШИ__1шш_ Н'1 mil "IPd >Я» И 1»шщ» Ir НМД» р t Ш>Т11> 17 К* я АГГ1И» Ku I »ТИИИ»1 HttlFl 1М»»»> Се' ДИАДЫ П. Ж ПЕРИОДЫ |








