Техника - молодёжи 1990-12, страница 11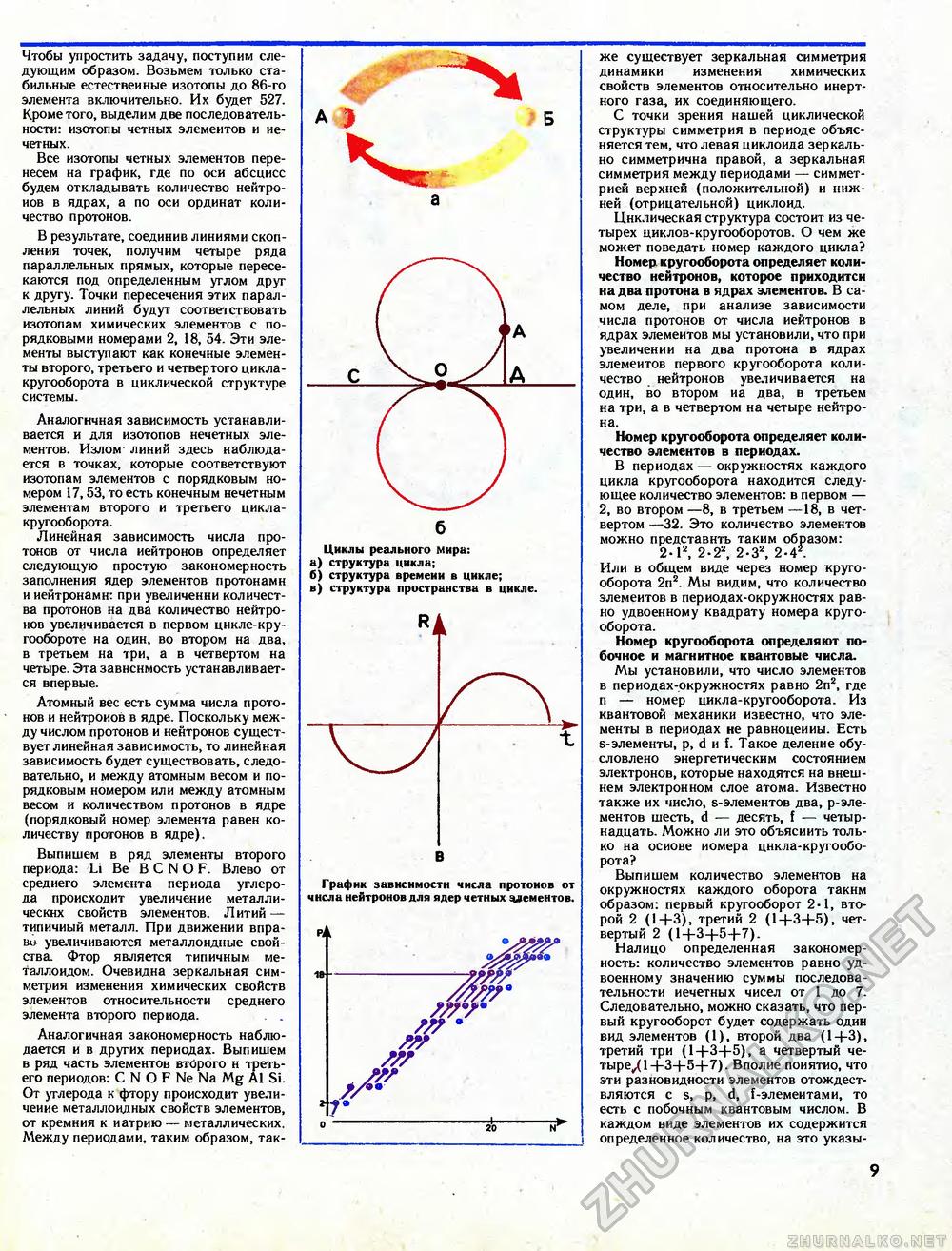
Чтобы упростить задачу, поступим следующим образом. Возьмем только стабильные естественные изотопы до 86-го элемента включительно. Их будет 527. Кроме того, выделим две последовательности: изотопы четных элементов и нечетных. Все изотопы четных элементов перенесем на график, где по оси абсцисс будем откладывать количество нейтронов в ядрах, а по оси ординат количество протонов. В результате, соединив линиями скопления точек, получим четыре ряда параллельных прямых, которые пересекаются под определенным углом друг к другу. Точки пересечения этих параллельных линий будут соответствовать изотопам химических элементов с порядковыми номерами 2, 18, 54. Эти элементы выступают как конечные элементы второго, третьего и четвертого цикла-кругооборота в циклической структуре системы. Аналогичная зависимость устанавливается и для изотопов нечетных элементов. Излом линий здесь наблюдается в точках, которые соответствуют изотопам элементов с порядковым номером 17,53, то есть конечным нечетным элементам второго и третьего цикла-кругооборота. Линейная зависимость числа протонов от числа нейтронов определяет следующую простую закономерность заполнения ядер элементов протонами и нейтронами: при увеличении количества протонов на два количество нейтронов увеличивается в первом цикле-кругообороте на один, во втором на два, в третьем на три, а в четвертом на четыре. Эта зависимость устанавливается впервые. Атомный вес есть сумма числа протонов и нейтронов в ядре. Поскольку между числом протонов и нейтронов существует линейная зависимость, то линейная зависимость будет существовать, следовательно, и между атомным весом и порядковым номером или между атомным весом и количеством протонов в ядре (порядковый номер элемента равен количеству протонов в ядре). Выпишем в ряд элементы второго периода: Li Be В С N О F. Влево от среднего элемента периода углерода происходит увеличение металлических свойств элементов. Литий — типичный металл. При движении вправо увеличиваются металлоидные свойства. Фтор является типичным металлоидом. Очевидна зеркальная симметрия изменения химических свойств элементов относительности среднего элемента второго периода. . . Аналогичная закономерность наблюдается и в других периодах. Выпишем в ряд часть элементов второго н третьего периодов: С N О F Ne Na Mg А1 Si. От углерода к фтору происходит увеличение металлоидных свойств элементов, от кремния к натрию — металлических. Между периодами, таким образом, так- Циклы реального мира: а) структура цикла; б) структура времени в цикле; в) структура пространства в цикле. График зависимости числа протонов от числа нейтронов для ядер четных цементов. Pii /А //гг • /г/ /// же существует зеркальная симметрия динамики изменения химических свойств элементов относительно инертного газа, их соединяющего. С точки зрения нашей циклической структуры симметрия в периоде объясняется тем, что левая циклоида зеркально симметрична правой, а зеркальная симметрия между периодами — симметрией верхней (положительной) и нижней (отрицательной) циклоид. Циклическая структура состоит из четырех циклов-кругооборотов. О чем же может поведать номер каждого цикла? Номер, кругооборота определяет количество нейтронов, которое приходитси на два протона в ядрах элементов. В самом деле, при анализе зависимости числа протонов от числа нейтронов в ядрах элементов мы установили, что при увеличении на два протона в ядрах элементов первого кругооборота количество нейтронов увеличивается на один, во втором на два, в третьем на три, а в четвертом на четыре нейтрона. Номер кругооборота определяет количество элементов в периодах. В периодах — окружностях каждого цикла кругооборота находится следующее количество элементов: в первом — 2, во втором —8, в третьем —18, в четвертом —32. Это количество элементов можно представить таким образом: 2-12, 2-22, 2-32, 2-4 . Или в общем виде через номер кругооборота 2п2. Мы видим, что количество элементов в периодах-окружностях равно удвоенному квадрату номера кругооборота. Номер кругооборота определяют побочное и магнитное квантовые числа. Мы установили, что число элементов в периодах-окружностях равно 2п2, где п — номер цикла-кругооборота. Из квантовой механики известно, что элементы в периодах не равноценны. Есть s-элементы, р, d и f. Такое деление обусловлено энергетическим состоянием электронов, которые находятся на внешнем электронном слое атома. Известно также их число, s-элементов два, р-элементов шесть, d — десять, ! — четырнадцать. Можно ли это объяснить только на основе номера цикла-кругооборота? Выпишем количество элементов на окружностях каждого оборота таким образом: первый кругооборот 2-1, второй 2 (1+3), третий 2 (1+3+5), четвертый 2 (1+3+5+7). Налицо определенная закономерность: количество элементов равно удвоенному значению суммы последовательности нечетных чисел от 1 до 7. Следовательно, можно сказать, что первый кругооборот будет содержать один вид элементов (1), второй два (1+3), третий три (1+3+5), а четвертый четыре^ 1+3+5+7). Вполне понятно, что эти разновидности элементов отождествляются с s, р, d, f-элемеитами, то есть с побочным квантовым числом. В каждом виде элементов их содержится определенное количество, на это указы- 9 |








