Тело человека №35, страница 18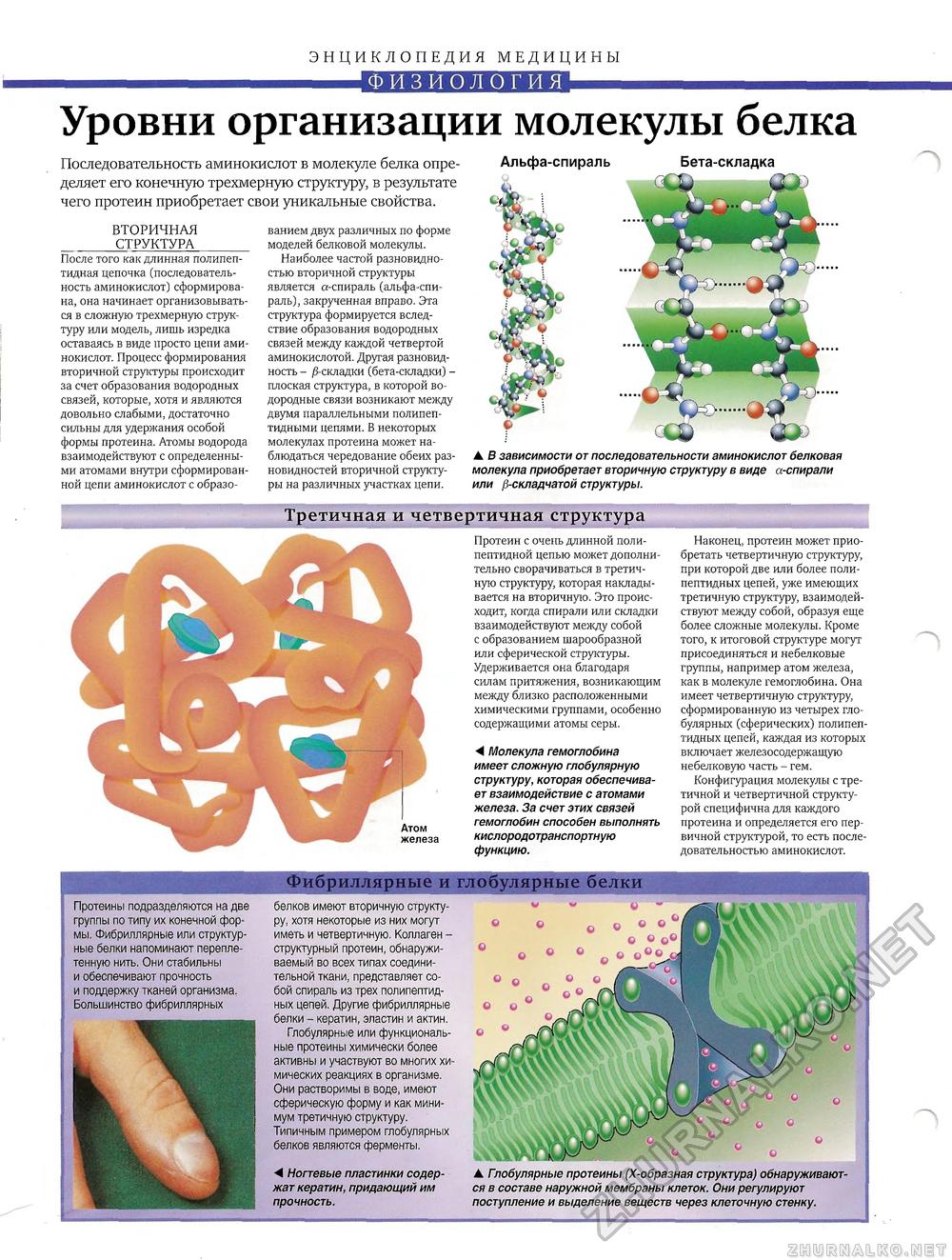
ЭНЦИКЛОПЕДИЯ МЕДИЦИНЫ ФИЗИОЛОГИЯУровни организации молекулы белка Последовательность аминокислот в молекуле белка определяет его конечную трехмерную структуру, в результате чего протеин приобретает свои уникальные свойства. ВТОРИЧНАЯ СТРУКТУРА После того как длинная полипептидная цепочка (последовательность аминокислот) сформирована, она начинает организовываться в сложную трехмерную структуру или модель, лишь изредка оставаясь в виде просто цепи аминокислот. Процесс формирования вторичной структуры происходит за счет образования водородных связей, которые, хотя и являются довольно слабыми, достаточно сильны для удержания особой формы протеина. Атомы водорода взаимодействуют с определенными атомами внутри сформированной цепи аминокислот с образо ванием двух различных по форме моделей белковой молекулы. Наиболее частой разновидностью вторичной структуры является а-спираль (альфа-спираль), закрученная вправо. Эта структура формируется вследствие образования водородных связей между каждой четвертой аминокислотой. Другая разновидность - /3-складки (бета-складки) -плоская структура, в которой водородные связи возникают между двумя параллельными полипептидными цепями. В некоторых молекулах протеина может наблюдаться чередование обеих разновидностей вторичной структуры на различных участках цепи. Третичная и четвертичная структураПротеины подразделяются на две группы по типу их конечной формы. Фибриллярные или структурные белки напоминают переплетенную нить. Они стабильны и обеспечивают прочность и поддержку тканей организма. Большинство фибриллярных Протеин с очень длинной полипептидной цепью может дополнительно сворачиваться в третичную структуру, которая накладывается на вторичную. Это происходит, когда спирали или складки взаимодействуют между собой с образованием шарообразной или сферической структуры. Удерживается она благодаря силам притяжения, возникающим между близко расположенными химическими группами, особенно содержащими атомы серы. А Молекула гемоглобина имеет сложную глобулярную структуру, которая обеспечивает взаимодействие с атомами железа. За счет этих связей гемоглобин способен выполнять кислородотранспортную функцию. Наконец, протеин может приобретать четвертичную структуру, при которой две или более полипептидных цепей, уже имеющих третичную структуру, взаимодействуют между собой, образуя еще более сложные молекулы. Кроме того, к итоговой структуре могут присоединяться и небелковые группы, например атом железа, как в молекуле гемоглобина. Она имеет четвертичную структуру, сформированную из четырех глобулярных (сферических) полипептидных цепей, каждая из которых включает железосодержащую небелковую часть - гем. Конфигурация молекулы с третичной и четвертичной структурой специфична для каждого протеина и определяется его первичной структурой, то есть последовательностью аминокислот. Фибриллярные и глобулярные белкибелков имеют вторичную структуру, хотя некоторые из них могут иметь и четвертичную. Коллаген -структурный протеин, обнаруживаемый во всех типах соединительной ткани, представляет собой спираль из трех полипептидных цепей. Другие фибриллярные белки - кератин, эластин и актин. Глобулярные или функциональные протеины химически более активны и участвуют во многих химических реакциях в организме. Они растворимы в воде, имеют сферическую форму и как минимум третичную структуру. Типичным примером глобулярных белков являются ферменты. А Ногтевые пластинки содержат кератин, придающий им прочность. ▲ Глобулярные протеины (Х-образная структура) обнаруживаются в составе наружной мембраны клеток. Они регулируют поступление и выделение веществ через клеточную стенку. Альфа-спираль Бета-складка ▲ В зависимости от последовательности аминокислот белковая молекула приобретает вторичную структуру в виде а-спирали или fi-складчатой структуры. |








