Техника - молодёжи 1938-03, страница 48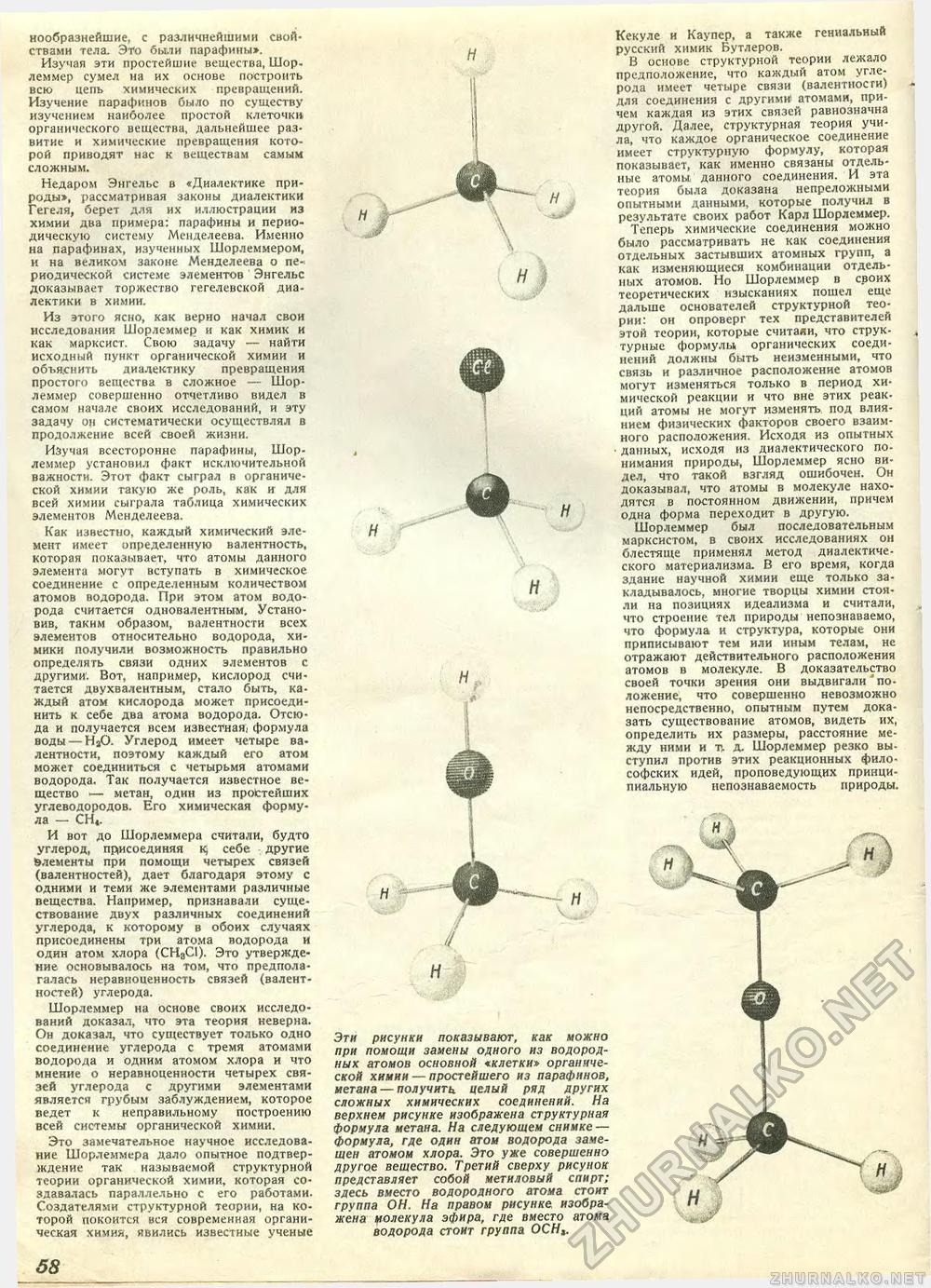
нообразнейшие, с различнейшими свойствами тела. Это были парафины». Изучая эти простейшие вещества, Шор-леммер сумел на их основе построить всю цепь химических превращений. Изучение парафинов было по существу изучением наиболее простой клеточки органического вещества, дальнейшее развитие и химические превращения которой приводят нас к веществам самым Недаром Энгельс в «Диалектике природы», рассматривая законы диалектики Гегеля, берет для их иллюстрации из химии два примера: парафины и периодическую систему Менделеева. Именно на парафинах, изученных Шорлеммером, и на великом законе Менделеева о периодической системе элементов Энгельс доказывает торжество гегелевской диалектики в химии. Из этого ясно, как верно начал свои исследования Шорлеммер и как химик и как марксист. Свою задачу — найти исходный пункт органической химии и объяснить диалектику превращения простого вещества в сложное — Шорлеммер совершенно отчетливо видел в самом начале своих исследований, и эту задачу он систематически осуществлял в продолжение всей своей жизни. Изучая всесторонне парафины, Шорлеммер установил факт исключительной важности. Этот факт сыграл в органической химии такую же роль, как и для всей химии сыграла таблица химических элементов Менделеева. Как известно, каждый химический элемент имеет определенную валентность, которая показывает, что атомы данного элемента могут вступать в химическое соединение с определенным количеством атомов водорода. При этом атом водорода считается одновалентным. Установив, таким образом, валентности всех элементов относительно водорода, химики получили возможность правильно определять связи одних элементов с другими'. Вот, например, кислород считается двухвалентным, стало быть, каждый атом кислорода может присоединить к себе два атома водорода. Отсюда и получается всем известная) формула воды — Н»0. Углерод имеет четыре валентности, поэтому каждый его атом может соединиться с четырьмя атомами водорода. Так получается известное вещество — метан, один из простейших углеводородов. Его химическая формула — СН,. И вот до Шорлеммера считали, будто углерод, присоединяя к; себе другие Элементы при помощи четырех связей (валентностей), дает благодаря этому с одними и теми же элементами различные вещества. Например, признавали существование двух различных соединений углерода, к которому в обоих случаях присоединены три атома водорода и один атом хлора (СН3С1). Это утверждение основывалось на том, что предполагалась неравноценность связей (валентностей) углерода. Шорлеммер на основе своих исследований доказал, что эта теория неверна. Он доказал, что существует только одно соединение углерода с тремя атомами водорода и одним атомом хлора и что мнение о неравноценности четырех связей углерода с другими элементами является грубым заблуждением, которое ведет к неправильному построению всей системы органической химии. Это замечательное научное исследование Шорлеммера дало опытное подтверждение так называемой структурной теории органической химии, которая создавалась параллельно с его работами. Создателями структурной теории, на которой покоится вся современная органическая химия, явились известные ученые Кекуле и Каупер, а также гениальный русский химик Бутлеров. В основе структурной теории лежало предположение, что каждый атом углерода имеет четыре связи (валентности) для соединения с другими атомами, причем каждая из этих связей равнозначна другой. Далее, структурная теория учила, что каждое органическое соединение имеет структурную формулу, которая показывает, как именно связаны отдельные атомы, данного соединения. И эта теория была доказана непреложными опытными данными, которые получил в результате своих работ Карл Шорлеммер. Теперь химические соединения можно было рассматривать не как соединения отдельных застывших атомных групп, а как изменяющиеся комбинации отдельных атомов. Но Шорлеммер в своих теоретических изысканиях пошел еще дальше основателей структурной теории: он опроверг тех представителей этой теории, которые считали, что струк-турные формулы органических соединений должны быть неизменными, что связь и различное расположение атомов могут изменяться только в период химической реакции и что вне этих реакций атомы не могут изменять, под влиянием физических факторов своего взаимного расположения. Исходя из опытных • данных, исходя из диалектического понимания природы, Шорлеммер ясно видел, что такой взгляд ошибочен. Он доказывал, что атомы в молекуле находятся в постоянном движении, причем одна форма переходит в другую. Шорлеммер был последовательным марксистом, в своих исследованиях он блестяще применял метод диалектического материализма. В его время, когда здание научной химии еще только закладывалось, многие творцы химии стояли на позициях идеализма и считали, что строение тел природы непознаваемо, что формула и структура, которые они приписывают тем или иным телам, не отражают действительного расположения атомов в молекуле. В доказательство своей точки зрения они выдвигали' положение, что совершенно невозможно непосредственно, опытным путем доказать существование атомов, видеть их, определить их размеры, расстояние между ними и т. д. Шорлеммер резко вы-ступил против этих реакционных философских идей, проповедующих принципиальную непознаваемость природы. Эти рисунки показывают, как можно при помощи замены одного из водородных атомов основной «клетки» органической химии — простейшего из парафинов, метана —получить целый ряд других сложных химических соединений. На верхнем рисунке изображена структурная формула метана. На следующем снимке — формула, где один атом водорода замещен атомом хлора. Это уже совершенно другое вещество. Третий сверху рисунок представляет собой метиловый спирт; здесь вместо водородного атома стоит группа ОН. На правом рисунке изображена ролекула эфира, где вместо атома водорода стоит группа ОСН,. •>4 |








