Техника - молодёжи 1941-05, страница 23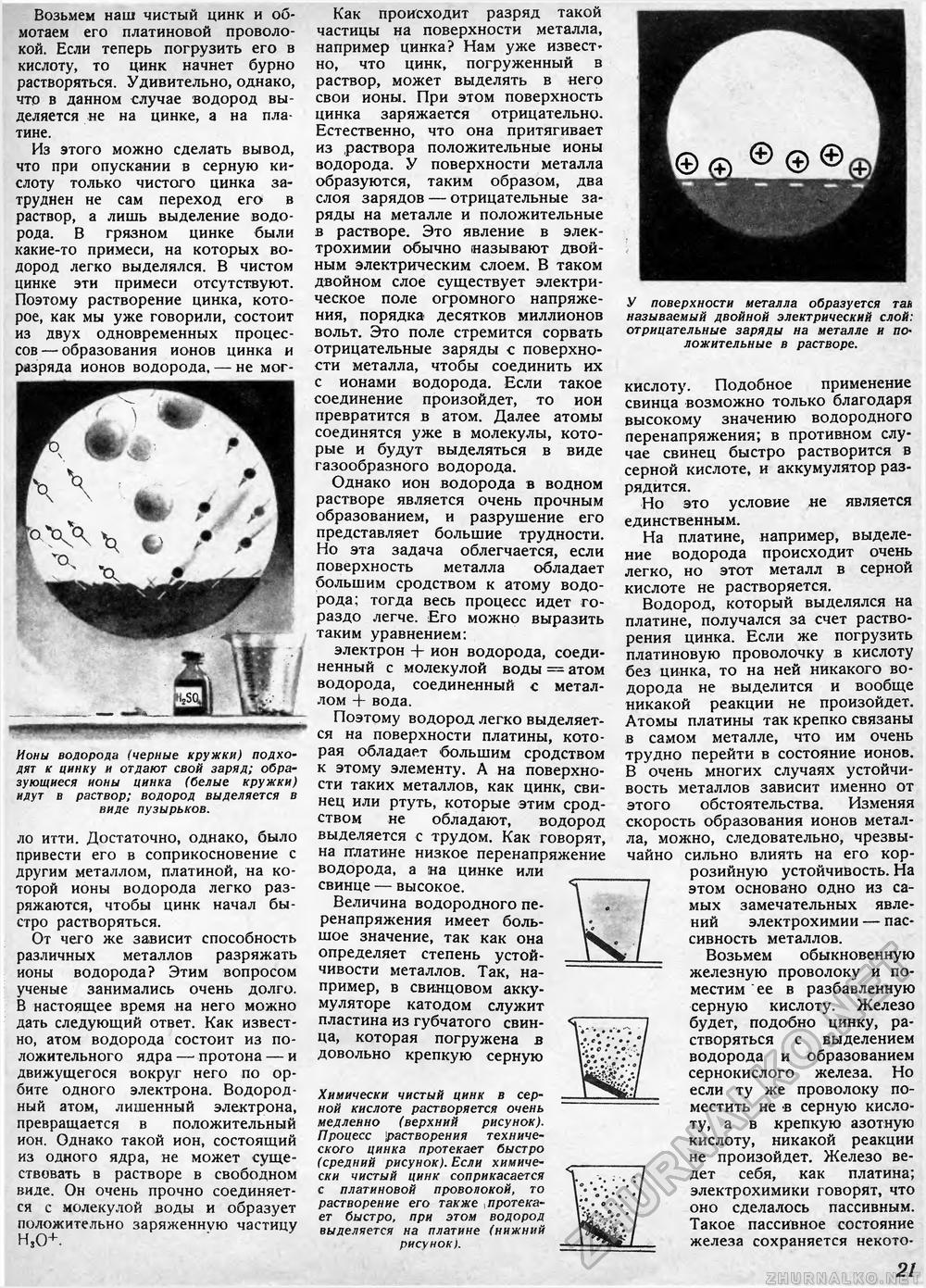
Возьмем наш чистый цинк и обмотаем его платиновой проволокой. Если теперь погрузить его в кислоту, то цинк начнет бурно растворяться. Удивительно, однако, что в данном случае водород выделяется не на цинке, а на платине. Из этого можно сделать вывод, что при опускании в серную кислоту только чистого цинка затруднен не сам переход его в раствор, а лишь выделение водорода. В грязном цинке были какие-то примеси, на которых водород легко выделялся. В чистом цинке эти примеси отсутствуют. Поэтому растворение цинка, которое, как мы уже говорили, состоит из двух одновременных процессов— образования ионов цинка и разряда ионов водорода, — не мог- ■ и ■ шщ\ \ ■ Ионы водорода (черные кружки) подходят к цинку и отдают свой заряд; образующиеся ионы цинка (белые кружки) идут в раствор; водород выделяется в виде пузырьков. ло итти. Достаточно, однако, было привести его в соприкосновение с другим металлом, платиной, на которой ионы водорода легко разряжаются, чтобы цинк начал быстро растворяться. От чего же зависит способность различных металлов разряжать ионы водорода? Этим вопросом ученые занимались очень долго. В настоящее время на него можно дать следующий ответ. Как известно, атом водорода состоит из положительного ядра —- протона — и движущегося вокруг него по орбите одного электрона. Водородный атом, лишенный электрона, превращается в положительный ион. Однако такой ион, состоящий из одного ядра, не может существовать в растворе в свободном виде. Он очень прочно соединяется с молекулой воды и образует положительно заряженную частицу Н,0+ Как происходит разряд такой частицы на поверхности металла, например цинка? Нам уже извест* но, что цинк, погруженный в раствор, может выделять в него свои ионы. При этом поверхность цинка заряжается отрицательно. Естественно, что она притягивает из раствора положительные ионы водорода. У поверхности металла образуются, таким образом, два слоя зарядов — отрицательные заряды на металле и положительные в растворе. Это явление в электрохимии обычно называют двойным электрическим слоем. В таком двойном слое существует электрическое поле огромного напряжения, порядка десятков миллионов вольт. Это поле стремится сорвать отрицательные заряды с поверхности металла, чтобы соединить их с ионами водорода. Если такое соединение произойдет, то ион превратится в атом. Далее атомы соединятся уже в молекулы, которые и будут выделяться в виде газообразного водорода. Однако ион водорода в водном растворе является очень прочным образованием, и разрушение его представляет большие трудности. Но эта задача облегчается, если поверхность металла обладает большим сродством к атому водорода; тогда весь процесс идет гораздо легче. Его можно выразить таким уравнением: электрон + ион водорода, соединенный с молекулой воды = атом водорода, соединенный с металлом + вода. Поэтому водород легко выделяется на поверхности платины, которая обладает большим сродством к этому элементу. А на поверхности таких металлов, как цинк, свинец или ртуть, которые этим сродством не обладают, водород выделяется с трудом. Как говорят, на платине низкое перенапряжение водорода, а на цинке или свинце — высокое. Величина водородного перенапряжения имеет большое значение, так как она определяет степень устойчивости металлов. Так, например, в свинцовом аккумуляторе катодом служит пластина из губчатого свинца, которая погружена в довольно крепкую серную Химически чистый цинк в серной кислоте растворяется очень медленно (верхний рисунок). Процесс растворения технического цинка протекает быстро (средний рисунок). Если химически чистый цинк соприкасается с платиновой проволокой, то растворение его также , протекает быстро, при этом водород выделяется на платине (нижний рисунокл У поверхности металла образуется тал называемый двойной электрический слой: отрицательные заряды на металле и положительные в растворе. кислоту. Подобное применение свинца возможно только благодаря высокому значению водородного перенапряжения; в противном случае свинец быстро растворится в серной кислоте, и аккумулятор разрядится. Но это условие не является единственным. На платине, например, выделение водорода происходит очень легко, но этот металл в серной кислоте не растворяется. Водород, который выделялся на платине, получался за счет растворения цинка. Если же погрузить платиновую проволочку в кислоту без цинка, то на ней никакого водорода не выделится и вообще никакой реакции не произойдет. Атомы платины так крепко связаны в самом металле, что им очень трудно перейти в состояние ионов. В очень многих случаях устойчивость металлов зависит именно от этого обстоятельства. Изменяя скорость образования ионов металла, можно, следовательно, чрезвычайно сильно влиять на его коррозийную устойчивость. На этом основано одно из самых замечательных явлений электрохимии — пассивность металлов. Возьмем обыкновенную железную проволоку и поместим ее в разбавленную серную кислоту. Железо будет, подобно цинку, растворяться с выделением водорода и образованием сернокислого железа. Но если ту же проволоку поместить не в серную кислоту, а в крепкую азотную кислоту, никакой реакции не произойдет. Железо ведет себя, как платина; электрохимики говорят, что оно сделалось пассивным. Такое пассивное состояние железа сохраняется некото 21 |








